私たちの“技術の集合体”が、医療の現場でもお役に立っています

私たち日本フェンオールが医療分野に進出したのは1980年。以来、何よりも患者さんにやさしい人工腎臓透析装置を提供できるよう、独自の研究開発、改良を重ね、品質向上及びコスト低減を図ってきました。
ドイツTUV(テユフ)による安全機器の認証であるGSマークに加え、1998年3月にはCEマーキングを取得した実績があります。
もともと温度制御用コントローラの分野で豊富な実績と技術の蓄積を持っており、透析装置に不可欠な流体温度/ 濃度制御・圧力制御(静脈圧・透析圧)・流量制御(血液ポンプ・シリンジポンプ・除水/ 注入ポンプ)・画面制御・表示(LCD・英語/スベイン/中国語等の多言語)及び各種検出ユニット(気泡検知・漏血検知)などの技術開発が私たちの得意分野です。さらに、透析以外の医療機器の実績も増やしており、医療の現場でますます貢献できるよう努力を続けていきます。
医薬品医療機器等法上の許可/登録
第一種医療機器製造販売業許可 許可番号 13B1X00193
医療機器製造業登録(長野工場) 登録番号 20BZ000123
医療機器製造業登録(八王子事業所) 登録番号 13BZ200870
サービス・提供内容
受託開発
人工腎臓透析装置の開発で培った精密、高度な技術で、医療機器の受託開発・共同開発を行います。
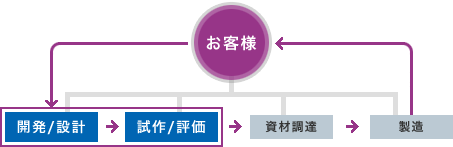
システム設計・開発
各種医療機器について、システム全体の設計から、仕様書の作成、機構・電気・ソフト開発を組み合わせた製品・部品の開発経験があります。
【装置開発例】
- 人工腎臓透析装置
- 血液浄化装置
- 冷却療法用装置
- 自動血圧計
など
【ユニット部品開発例】
- 気泡検知器
- 漏血検知器
- 各種ポンプユニット(血液・補液)
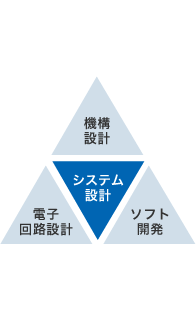
機構設計
3D CADを使用した筐体設計、樹脂部品・板金部品の設計や、ダイキャスト・ロストワックスを利用した機能部品・ユニット製品の開発・量産設計を行っています。
- AUTO CAD Inventor
- Solidworks

電気・電子回路設計
人工腎臓透析装置に搭載されるCPUボード、アナログ回路、LCDユニット、電源ユニットなどの各種電気・電子回路設計、試作・量産設計を行っています。
ソフトウェア開発
人工透析装置などの高度な医療機器に搭載されるソフトウェアは、動作中の状態を複数のマイコンで相互監視するなど、高度なアーキテクチャ設計と高い信頼性が要求されます。
当社は永年培ってきた品質管理システムをベースに、豊富な実績とノウハウを生かしたチームワークでソフトウェアを開発しています。
- 各種デバイスのリアルタイム制御
- 多様なセンサーによる監視
- タッチ操作を主体とした直感的なUI
- PCやモバイルデバイスなどとのネットワーク通信

試作・評価
- 基板製作(弊社PWBA部門にて試作・量産が可能です)
- 3Dプリンタ(簡易評価が可能です)
- EMC評価(社内の電波暗室(3mシールドルーム)で、EMCの事前評価が可能です)
- 三次元測定器
これらの設備を利用して、開発・試作・評価の期間短縮とコスト低減が可能です。


受託生産
高度な技術と信頼性の求められる、パートナー様のさまざまな医療機器の受託生産を行っています。
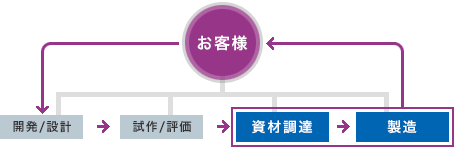
製造部門
製造部門はお客様のQCD( Quality:品質、Cost:コスト、Delivery:納期 )のニーズにお応えします。
製造ライン - 部材・部品製造工程
メディカル部門全体で、内製化率の向上に取り組んでいます。
製造ライン(直線ライン)- 組み立て工程
かつては複数のラインで製造していた工程を見直し「1個流し生産」の直線ラインで、製造に関わるムダを削減しています。
調整・検査ライン
出荷前の各機能の動作確認を行う工程でも、治具の配置、工程の見直しを行うことでより効率の高い作業を実現しています。
梱包・出荷
社内で梱包まで行い、効率化・省力化を図っています。
施設・設備
透析機器用の検査水浄化設備や製造装置など、実際の使用環境を想定した試験・製造設備を備えています。
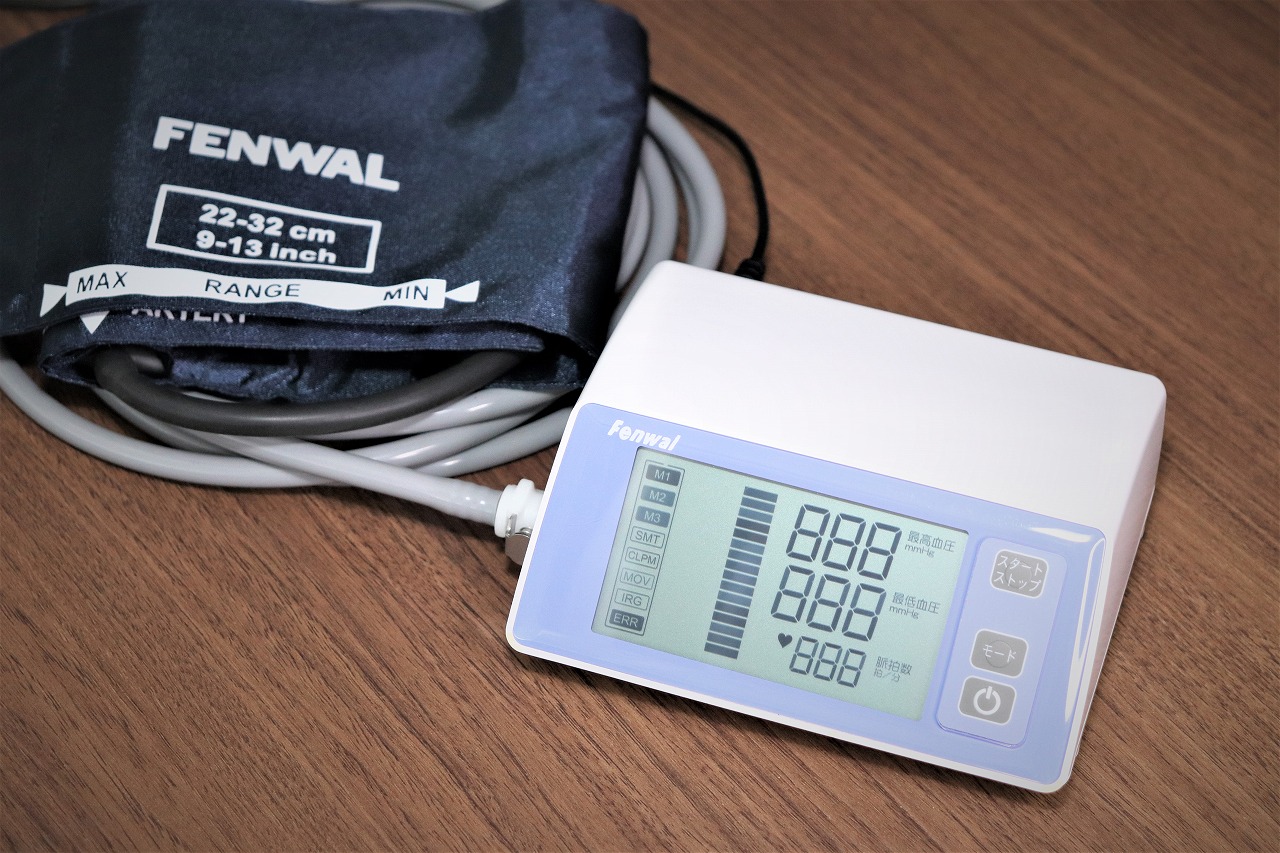
主要製品「血圧計ユニット:FMT2100-U」
これ1台で、3モードの測定方法が選択できる、医用電子血圧計です。
【特長】
- 特長(1)リニア減圧測定・カフで上腕を締め付け、一定速度で排気しながら血圧測定を行う方式です。血圧測定時間が短時間に行えるメリットがあります。
- 特長(2)ステップ減圧測定・カフで上腕を締め付け、定期的に排気を止めながら血圧測定を行う方式です。測定時に排気を止めている為、血圧値が正確に測れるメリットがあります。
- 特長(3)ステップ加圧測定・カフで上腕を締め付ける際、定期的に加圧しながら血圧測定を行う方式です。最高血圧が測定できた段階で血圧測定が終了する為、上腕の締め付けが緩和されます。
認証番号:226AHBZX00024000
型式承認 第Q1417号
主要製品「内蔵モジュール : FMT2100-M」
上記の測定モードを搭載した、機器組込型の内蔵モジュールです。
型式承認 第Q1417号

認証・規格への対応
国内・海外への進出に必須となる、医療機器の開発・製造に必要なさまざまな許認可を取得しています。医療機器の国内・海外認証取得に必要となる以下の主要規格について開発管理システムとして対応しています。
- ISO13485 : 医療機器品質マネジメントシステム
- ISO14971 : 医療機器リスクマネジメント
- ISO14001 : 環境マネジメントシステム
- IEC62366 : 医療機器ユーザビリティエンジニアリング
- IEC62304 : 医療機器ソフトウェアライフサイクルプロセス
- IEC60601-1(JIS T 0601-1) : 医用電気機器電気安全性
- IEC60601-1-2(JIS T 0601-1-2) : 医用電気機器電磁両立性
- RoHS指令・REACH規制
その他製品個々に必要な規格に対応します。
- IEC60601-2-16 (JIT T 0601-2-16) : 医療機器透析装置の特定要求事項
- IEC60601-2-30 : 医療機器自動血圧計の特定要求事項
ISO14971とは
医療機器に存在しているリスクを設計・開発段階ですべて洗い出し、対策することによって使用者(患者、病院関係者)に危害を及ぼさないようにする 活動を規定した国際規格。市販後の市場からの製品(類似製品を含む)に対するフィードバック情報もこの活動の一部になる。
ISO13485とは
ISO13485は各国の法規制における要求事項を満たし、安全で有用な製品の継続的な製造・供給を行うための医療機器産業向けの品質マネジメン トシステムの世界標準規格です。
IEC62366とは
医療機器の誤操作が起因する医療ミスをなくす為、医療機器の安全に関係する範囲で、その使いやすさ(ユーザビリティ)を分析し、指定し、設計し、 検証し、妥当性確認をおこなうためのプロセスを規定した国際規格。このユーザビリティエンジニアリングプロセスは、正常使用時に付随するリスク(使用 ミス)を評価し、軽減するものである。
IEC62304とは
医療機器ソフトウェアの安全設計・保守に必要なライフサイクルプロセスに関する国際規格で、「安全」を実現目標にしたソフトウェアの品質管理が目的 ソフトウェアの設計開発・検証・妥当性確認、及び維持などの製品ライフサイクルを通して適用される。
許認可
医薬品医療機器等法上の許可/登録
- 第一種医療機器製造販売業許可 許可番号13B1X00193
- 医療機器製造業登録(長野工場) 登録番号20BZ000123
- 医療機器製造業登録(八王子事業所) 登録番号13BZ200870
各国の許認可
| 台湾 (QSD) 認証 | ブラジル認証 |
過去取得実績
| 欧州 (CEマーキング) 認証 (Annex V) | ロシア認証 |
| ペルー認証 | 中国 (CCC) 認証 |
| ウルグアイ認証 | カナダ (SCC) 認証 |
| キューバ認証 | インドネシア認証 |
| 韓国 (KFDA) 認証 |

